Tratamento com células Car-T apresenta primeiros resultados em Ribeirão Preto
Pesquisadores brasileiros estão trabalhando para baratear um dos tratamentos mais promissores — e caros — da oncologia mundial. A terapia celular CAR-T, que utiliza células do próprio paciente modificadas em laboratório para atacar o câncer, pode custar até R$ 3 milhões por pessoa no setor privado.
A técnica, que modifica geneticamente células de defesa do próprio paciente para que reconheçam e destruam tumores, já é usada comercialmente no exterior — e em casos pontuais no país —, mas ainda esbarra em altos custos e limitações de infraestrutura para se tornar amplamente disponível no Sistema Único de Saúde (SUS).
Hoje, esse é um dos tratamentos mais caros disponíveis porque toda a tecnologia é importada e paga em dólar. Agora, pesquisadores brasileiros estão trabalhando para que o país tenha autonomia na técnica e que a terapia fique disponível no SUS e na rede particular. A meta é tornar o tratamento 80% mais barato.
O g1 ouviu os pesquisadores à frente das principais iniciativas brasileiras na área, que explicaram o funcionamento da terapia, os obstáculos enfrentados e o que falta para que o tratamento chegue a mais pacientes.
Abaixo, você vai ler:
O que é a terapia CAR-T?
Como funciona hoje no Brasil?
O avanço da produção nacional
Os desafios técnicos
Efeitos colaterais e riscos
O futuro da CAR-T no Brasil
Como participar dos estudos?
Exames mostram antes e depois de câncer de paciente; à direita, imagem mostra remissão da doença
Arquivo pessoal
O que é a terapia CAR-T?
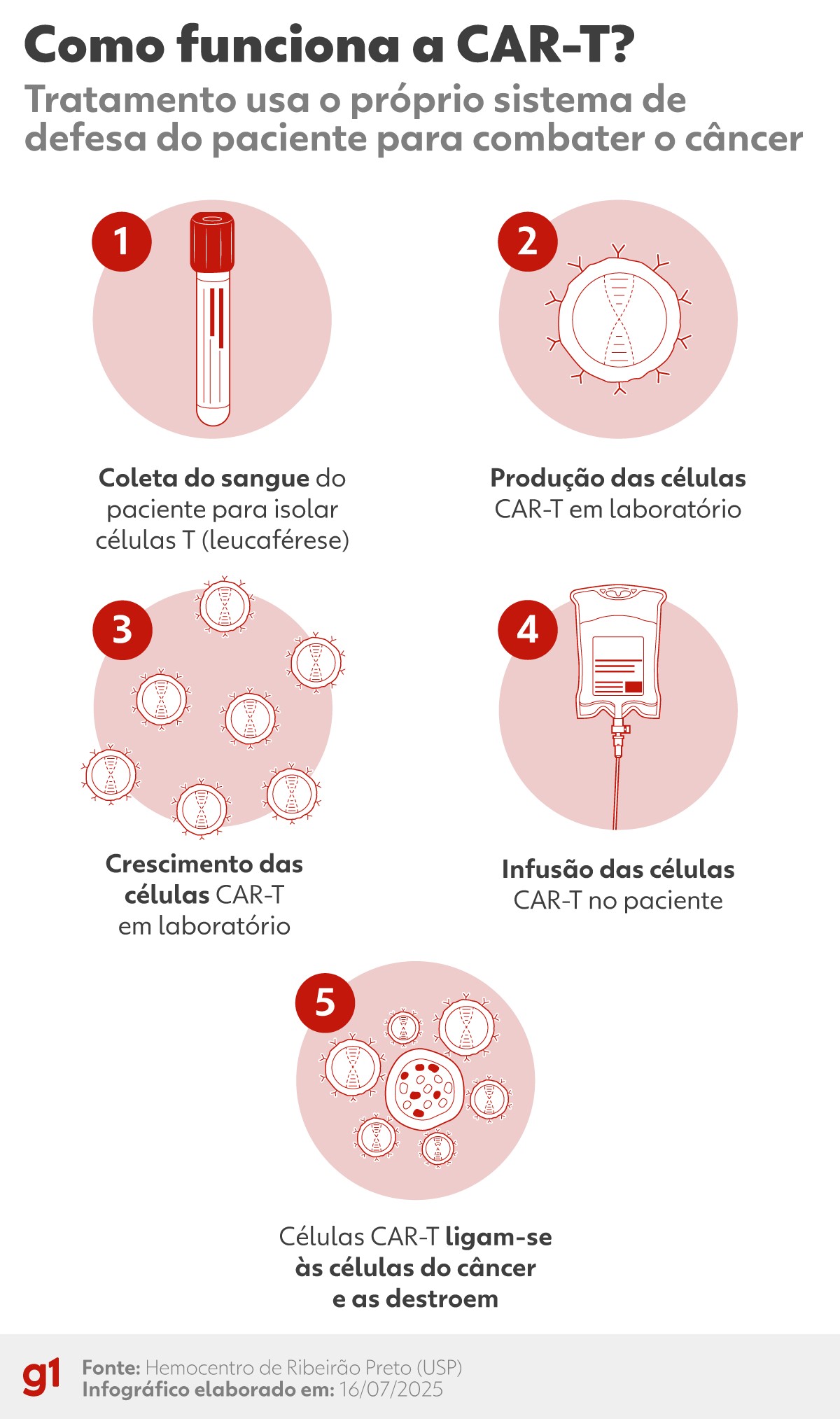
A sigla CAR-T vem de Chimeric Antigen Receptor T-cell (Célula T receptora de antígeno quimérico, em traduçaõ livre). A técnica consiste em coletar linfócitos T (células do sistema imune) do paciente, modificá-los geneticamente em laboratório para que reconheçam um alvo específico no tumor — geralmente o CD-19, presente em leucemias e linfomas —, e reintroduzi-los no organismo.
Esses “linfócitos reprogramados” passam a atacar as células doentes como um exército vivo.
“É uma droga viva. A célula modificada continua agindo por muito tempo. Há pacientes tratados há mais de dez anos com as células ainda ativas”, explica o imunologista Martin Bonamino, chefe do Programa de Imunoterapia Celular e Gênica do Instituto Nacional do Câncer (INCA).
Hemocentro de Ribeirão Preto (USP)/arte g1
Como funciona hoje no Brasil?
O tratamento com CAR-T já está aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa) para alguns tipos de leucemias, linfomas e mieloma múltiplo, mas ainda não está incorporado nem ao SUS nem à saúde suplementar.
Pacientes que recebem o tratamento com produtos comerciais — oferecidos por três farmacêuticas — precisam recorrer à Justiça para que os planos de saúde cubram o valor, que pode ultrapassar R$ 3 milhões.
Atualmente, as células são colhidas no Brasil, enviadas para fábricas nos Estados Unidos ou Europa, modificadas e congeladas, e só então retornam para aplicação — um processo que pode levar mais de 40 dias. “Essa espera é inviável para muitos pacientes em estado avançado”, alerta Bonamino.
Estudos clínicos com células Car-T trazem esperança para pacientes brasileiros com câncer
O avanço da produção nacional
Para reduzir custos e agilizar o tratamento, diferentes centros brasileiros estão desenvolvendo terapias CAR-T 100% nacionais. Um dos projetos mais avançados é liderado pelo Hemocentro de Ribeirão Preto, em parceria com a Universidade de São Paulo (USP) e o Instituto Butantan.
Segundo Rodrigo Calado, presidente do Hemocentro, o grupo já iniciou um estudo clínico de fase 1/2 com 81 pacientes.
“Tratamos 20 pacientes em uso compassivo, com resultados semelhantes aos oferecidos por produtos internacionais”, diz. A meta agora é concluir os testes para obter o registro da Anvisa. Com apoio de R$ 100 milhões do Ministério da Saúde, a expectativa é oferecer o tratamento ao SUS por 10% a 15% do valor cobrado atualmente no mercado privado.
Outros centros também estão na corrida, como o Hospital Israelita Albert Einstein, que já trata pacientes com células fabricadas no próprio hospital, e o INCA, que está estruturando laboratórios em parceria com a Fundação Oswaldo Cruz (Fiocruz) para viabilizar a produção em larga escala.
CAR-T Cell: Linfócitos retirados do paciente e modificados em laboratório voltam à corrente sanguínea e combatem células cancerígenas;
Arte/g1
Os desafios técnicos
A fabricação das células CAR-T exige ambientes altamente controlados, com salas limpas, filtros de ar e processos de assepsia rigorosos. “É mais parecido com a produção de um medicamento do que com um procedimento hospitalar”, resume Bonamino.
Outro gargalo é a produção dos vetores virais usados para inserir o gene modificador nos linfócitos. Na maior parte das CAR-T, é um vírus que ‘direciona’ a célula modificada até o tumor.
“Hoje, esses vírus são comprados de fora e custam até US$ 1,2 milhão por lote”, afirma o pesquisador. Para driblar essa dependência, a Fiocruz pretende adaptar a fábrica usada na pandemia para produzir vacinas de vetor viral e fabricar os insumos localmente.
O hemocentro de Ribeirão Preto conseguiu nacionalizar também esse processo, sendo o único entre os estudos que executa do início ao fim da produção no Brasil.
No INCA, também está em andamento o desenvolvimento de uma alternativa sem o uso de vírus, utilizando apenas fragmentos de DNA para inserir a modificação genética nas células.
Efeitos colaterais e riscos
Apesar do potencial revolucionário, a terapia CAR-T não está isenta de efeitos colaterais. Um dos principais é a “síndrome de liberação de citocinas”, uma inflamação aguda que pode causar febre, pressão baixa e, em casos mais graves, neurotoxicidade.
“Por isso, os pacientes precisam estar internados ou muito próximos a centros com UTI disponível”, explica Bonamino. “Mas sabemos manejar bem esses eventos, que geralmente são transitórios.”
Além disso, como a terapia elimina células B normais junto com as doentes, os pacientes podem ficar temporariamente imunossuprimidos e precisar de reposição de imunoglobulina.
O futuro da CAR-T no Brasil
A expectativa dos pesquisadores é que os estudos sejam concluídos em 2026, inicialmente em pacientes com leucemia linfoblástica B e linfoma difuso de grandes células B, que falharam em ao menos duas linhas de tratamento.
Estudos também estão sendo planejados para outras doenças autoimunes, como lúpus. “Já conseguimos controlar toda a cadeia de produção no Brasil, da fabricação do vetor à aplicação no paciente”, diz Calado. “Nosso objetivo é oferecer essa terapia ao SUS com qualidade e custo viável.”
Bonamino destaca que o avanço não é só clínico, mas estratégico: “Estamos construindo capacidade tecnológica, científica e industrial no Brasil. Isso nos dá autonomia e reduz a dependência de insumos internacionais.”
🧬 O que é preciso para a CAR-T virar realidade no SUS?
Conclusão dos estudos clínicos nacionais com aprovação da Anvisa
Produção local dos vetores virais ou alternativas sem vírus
Infraestrutura laboratorial adequada em hospitais públicos
Incorporação da tecnologia via Conitec (Comissão Nacional de Incorporação de Tecnologias no SUS)
Apoio contínuo de políticas públicas e financiamento federal
📌 Como participar dos estudos?
A participação em estudos clínicos deve ser solicitada pelo médico que acompanha o paciente junto ao centro de pesquisa.




